Basenstärke von Ammoniak
Gewinnung von Ammoniak(g) und pKB-Bestimmung mit pro++chem
Der Versuch besteht aus zwei Teilen. Teil A behandelt die Herstellung von gasförmigem Ammoniak und Teil B die Bestimmung der Basenstärke von Ammoniak mit Hilfe einer Titration und deren Aufzeichnung und Auswertung mit pro++chem.
Versuchsteil A) Gewinnung von Ammoniak-Gas
Versuchsaufbau: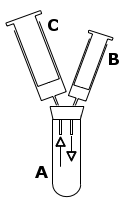
| Geräte: |
Miniapparatur bestehend aus:
Stativ, Klammer, Muffe, |
| Chemikalien |
Ammoniumchlorid, Vorarbeit: Vor der Versuchsdurchführung sollte man die Stoffportionen an Ammoniumchlorid und Natriumhydroxid berechnen, die erforderlich sind, um 100 ml (oder 150 ml) Ammoniak zu erzeugen. |
| Durchführung: |
Der Versuch sollte im Abzug durchgeführt werden! Die Wasserzugabe aus Spritze B sollte nicht zu großzügig bemessen werden, da sonst die Gefahr bestünde, dass sich das gebildete Ammoniakgas im Wasser auflöst und in der Miniapparatur einen Unterdruck erzeugt, der alles Wasser aus Spritze B in das Reagenzglas A saugen könnte.
Ist ein ausreichend großes Volumen (ca. 40 ml) an Ammoniak in Spritze C aufgefangen worden, schraubt man Spritze C von der Kanüle ab und taucht sie rasch in ein Becherglas, in dem sich ca. 60 ml Wasser befinden. In die Spritze eindringendes Wasser löst sofort das gesamte Ammoniakgas und bewirkt einen Unterdruck, der Wasser aus dem Becherglas als "Springbrunnen" in die Spritze drückt.
|
Versuchsteil B) Neutralisation der Ammoniak-Lsg. und pKB-Ermittlung
Versuchsaufbau: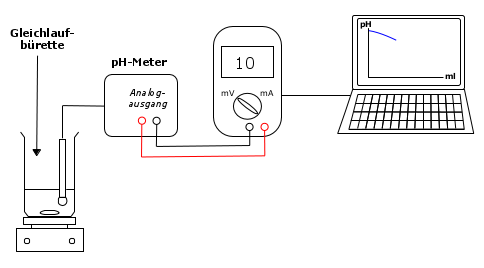
| Geräte: |
Computer, pro++chem ist installiert |
| Chemikalien: |
Ammoniak-Lsg. (aus Teil A), |
| Durchführung: |
Das pH-Meter wird über seinen Schreiber-/Analog-Ausgang an die Eingänge des Multimeters angeschlossen, das seinerseits über den AD-Ausgang mit der seriellen Schnittstelle oder dem USB-Port (USB-Seriell-Adapter) des Computers verbunden ist. Da am pH-Meter-Ausgang eine Gleichspannung anliegt, muss der Messbereich des Multimeters entsprechend im niedrigen V-Bereich eingestellt werden. Hinweis: Dieser Wert wird vom Programm intern genutzt, um aus der eigentlich erfassten Messzeit das Volumen an aktuell zugetropfter Säure zu berechnen und dem gemessenem pH-Wert als x-Wert zuzuordnen. Im Koordinatensystem wird die x-Achse mit der Einheit ml beschriftet. Nach der Auswahl und dem Öffnen der Schnittstelle (= Verbindung zwischen Wandler und Computer, COM- oder USB-Port) kann die Messaufnahme durch einen LMT-Klick auf die Schaltfläche 'Messung starten' und zeitgleicher Öffnung der Gleichlaufbürette begonnen werden. Unter Rühren tropft die Salzsäure zur Ammoniak-Lösung. Fortlaufend wird der pH-Wert in der Reaktionslösung gemessen und vom Programm zusammen mit dem Volumen an zugefügter Säure aufgezeichnet und als Messkurve grafisch dargestellt. Worauf man während der Messung achten sollte:
|
|
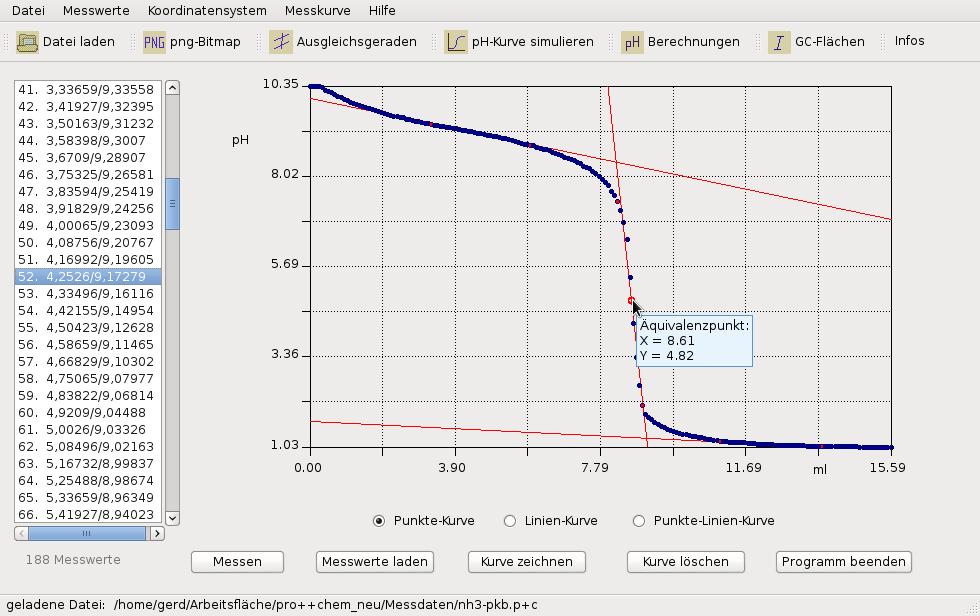
Die Titrationskurve eines Beispielversuches, aufgenommen und ausgewertet mit pro++chem
Wie der Abb. oben zu entnehmen ist, beträgt der Wert der x-Koordinate (→ Volumen an Maßlösung) am Äquivalenzpunkt 8,6. Demzufolge muss der Halbäquivalenzpunkt der Titration nach der Zugabe von 4,3 ml Salzsäure erreicht sein. In der eingeblendeten Listenanzeige (Strg+A) wurden die Messwerte, die dem Halbäquivalenzpunkt am ehesten entsprechen, durch einen LMT-Klick (blauer Balken) markiert. Am Halbäquivalenzpunkt beträgt der gemessene pH-Wert ca. 9,2. Das entspricht einem pKB-Wert von 14-pH = 4,8. Als Ergebnis erhält man: pKB(Ammoniak) = 4,8.
|